Terceira Avaliação
01/12/2016
Isomeria

Na reação por adição, a junção de duas ou mais moléculas originam unicamente um produto.
Exemplos:

Duas moléculas (cetaldeído e H2) se juntam para formar o etanol (CH3CH2OH).

A molécula de eteno (C2H4) se une ao H2 (gás hidrogênio) e dá origem ao produto etano (C2H6).
Reação de Substituição
Neste caso, um átomo ou grupo de átomos é substituído por um radical do outro reagente, ou seja, ocorre na molécula a troca de um ligante.

Repare que um hidrogênio da molécula de Metano foi substituído por um átomo de cloro, dando origem aos produtos cloro-metano e cloreto de hidrogênio.
Reação de Eliminação
Nesse tipo de reação ocorre a saída de ligantes de uma molécula sem que aconteça a substituição desses ligantes por outros.

A desidratação intramolecular de alcoóis é uma reação de Eliminação, onde os átomos na molécula do reagente orgânico (propanol) diminuem em razão da saída da molécula de água
Segunda Avaliação
27/10/2016
Funções Orgânicas
.jpg)
.jpg)
.jpg)
.jpg)
Mãos sujas de graxa e gasolina em estrada não se misturando com a água
.jpg)
Compostos orgânicos nos três estados físicos
.jpg)
Os combustíveis usados nos automóveis são todos compostos orgânicos
01/12/2016
Isomeria
Isomeria é o fenômeno de dois ou mais compostos apresentarem a mesma fórmula molecular (F.M.) e fórmulas estruturais diferentes. Os compostos com estas características são chamados de isômeros (iso = igual; meros = partes).
Vamos estudar dois casos de isomeria: a isomeria plana e a isomeria espacial.
2- Isomeria Plana
Isômeros planos são os que diferem pelas fórmulas estruturais planas.
Existem vários tipos de isômeros planos:
2.1- Isomeria de Cadeia
São isômeros pertencentes a uma mesma função química com cadeias carbônicas diferentes.
- Cadeia normal X cadeia ramificada
Exemplo: F.M. C4H10 – n-butano e metilpropano.
Exemplo: F.M. C4H10 – n-butano e metilpropano.
- Cadeia aberta insaturada X cadeia fechada saturada
Exemplo: F.M. C3H6 – propeno e ciclopropano.
Exemplo: F.M. C3H6 – propeno e ciclopropano.
- Cadeia aberta insaturada X cadeia fechada insaturada
Exemplo: F.M. C3H4 – propino e propadieno e ciclopropeno.
Exemplo: F.M. C3H4 – propino e propadieno e ciclopropeno.
- Cadeia homogênea X cadeia heterogênea
Exemplo: F.M. C2H7N – etilamina e dimetilamina.
Exemplo: F.M. C2H7N – etilamina e dimetilamina.
2.2- Isomeria de Posição
São isômeros de mesma função química, de mesma cadeia carbônica e que diferem pela posição de um grupo funcional, radical ou insaturação.
- Diferente posição de um radical
Exemplo: F.M. C6H14 – 2-metilpentano e 3-metilpentano.
Exemplo: F.M. C6H14 – 2-metilpentano e 3-metilpentano.
- Diferente posição de um grupo funcional
Exemplo: F.M. C3H8O – 1-propanol e 2-propanol.
Exemplo: F.M. C3H8O – 1-propanol e 2-propanol.
- Diferente posição de uma insaturação
Exemplo: F.M. C4H8 – 1-buteno e 2-buteno.
Exemplo: F.M. C4H8 – 1-buteno e 2-buteno.
2.3- Isomeria de Função
Os isômeros de função pertencem a funções diferentes.
Os três casos de isomeria funcional são:
Os três casos de isomeria funcional são:
- Álcool e Éter → CnH2n+2O
- Aldeído e Cetona → CnH2nO
- Ácido e Éster → CnH2nO2
- Aldeído e Cetona → CnH2nO
- Ácido e Éster → CnH2nO2
Exemplos:
- F.M. C2H6O – etanol e metoximetano;
- F.M. C3H6O – propanal e propanona;
- F.M. C3H6O2 ácido propanóico e etanoato de metila.
- F.M. C2H6O – etanol e metoximetano;
- F.M. C3H6O – propanal e propanona;
- F.M. C3H6O2 ácido propanóico e etanoato de metila.
2.4- Isomeria de Compensação ou Metameria
São isômeros de mesma função química, com cadeias heterogêneas, que diferem pela localização do heteroátomo nas cadeias.
Exemplos:
- F.M. C4H10O – metoxipropano e etoxietano;
- F.M. C4H11N – metil-propilamina e dietilamina.
- F.M. C4H10O – metoxipropano e etoxietano;
- F.M. C4H11N – metil-propilamina e dietilamina.
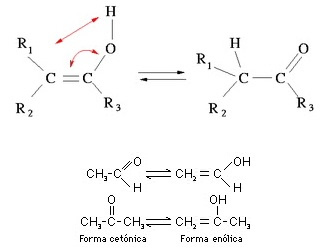
2.5- Tautomeria ou Isomeria Dinâmica
É um caso particular de isomeria funcional, pois os isômeros pertencem a funções químicas diferentes, com a característica de um deles ser mais estável que o outro.
Os isômeros coexistem em solução aquosa, mediante equilíbrio dinâmico no qual um isômero se transforma em outro pela transposição intramolecular simultânea de um átomo de hidrogênio e uma dupla ligação.
Exemplos:

3- Isomeria Espacial
Neste caso, os isômeros têm a mesma fórmula molecular e fórmula espacial diferente. Existem dois casos de isomeria espacial: Geométrica ou Cis – Trans e Óptica.
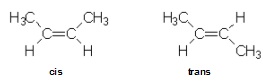
4- Isomeria Geométrica
Um composto apresenta isomeria geométrica ou cis-trans quando:
a) tiver dupla ligação carbobo-carbono, e
b) tiver ligantes diferentes a cada carbono da dupla ligação.
Os isômeros cis e trans diferem pela fórmula espacial. No isômero cis, os ligantes iguais ficam do mesmo lado do plano da dupla ligação. No isômero trans, os ligantes iguais ficam em lados opostos ao palno da dupla.
Exemplo:

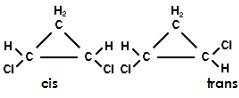
4.1- Condições para ocorrer isomeria geométrica em compostos de cadeia fechada (Bayeriana)
Em pelo menos dois átomos de carbono do ciclo, devemos encontrar dois ligantes diferentes entre si.
Em pelo menos dois átomos de carbono do ciclo, devemos encontrar dois ligantes diferentes entre si.
Exemplo:

5- Propriedades físicas e químicas dos isômeros geométricos
Os isômeros cis-trans apresentam propriedades físicas diferentes.
As propriedades químicas dos isômeros cis-trans são iguais.
As propriedades químicas dos isômeros cis-trans são iguais.
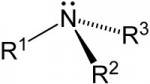
6- Isomeria Óptica
É um caso de isomeria espacial cujos isômeros apresentam a propriedade de desviar o plano de vibração da luz polarizada.
6.1- Condições:
I- carbono assimétrico (C*)
II- assimetria molecular (S)
II- assimetria molecular (S)
6.2- Carbono Assimétrico (C*) ou Quiral
Um carbono assimétrico é o carbono que possui as quatro valências ou os quatro radicais diferentes.
Um carbono assimétrico é o carbono que possui as quatro valências ou os quatro radicais diferentes.
Exemplo:

6.3- Luz Natural
Apresenta ondas eletromagnéticas em infinitos planos de vibração.
Apresenta ondas eletromagnéticas em infinitos planos de vibração.
6.4- Luz Polarizada
É a luz que apresenta ondas eletromagnéticas vibrando num único plano.
É a luz que apresenta ondas eletromagnéticas vibrando num único plano.
6.5- Substâncias Opticamente Ativas (SOA)
São as substâncias que desviam o plano de vibração da luz polarizada.
São as substâncias que desviam o plano de vibração da luz polarizada.
6.6- Substâncias Opticamente Inativas (SOI)
São as que não desviam o plano de vibração de luz polarizada.
São as que não desviam o plano de vibração de luz polarizada.
6.7- Substâncias Dextrogiras
São as substâncias que desviam o plano da luz polarizada para a direita.
São as substâncias que desviam o plano da luz polarizada para a direita.
6.8- Substâncias Levógiras
São as substâncias que desviam o plano da luz polarizada para a esquerda.
São as substâncias que desviam o plano da luz polarizada para a esquerda.
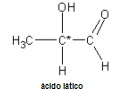
6.9- Substâncias com 1 carbono Assimétrico
Toda substância que apresenta um carbono assimétrico tem dois isômeros espaciais: um dextrógiro e um levógiro.
Toda substância que apresenta um carbono assimétrico tem dois isômeros espaciais: um dextrógiro e um levógiro.

Existem dois ácidos láticos espacialmente diferentes: o ácido lático dextrógiro e o levógiro.
Enantiomorfos são isômeros cujas moléculas se comportam como objeto e imagem (antípodas ópticos).
VEJAM ESSES VIDEOS, DE UM CANAL MUITO BOM DO YOU TUBE, QUE AJUDARÃO:
Reações Orgânicas
Uma reação orgânica pode ocorrer de diferentes maneiras, neste mostraremos a Reação por Adição, Substituição e Eliminação.
Reação de Adição
Reação de Adição
Na reação por adição, a junção de duas ou mais moléculas originam unicamente um produto.
Exemplos:

Duas moléculas (cetaldeído e H2) se juntam para formar o etanol (CH3CH2OH).

A molécula de eteno (C2H4) se une ao H2 (gás hidrogênio) e dá origem ao produto etano (C2H6).
Reação de Substituição
Neste caso, um átomo ou grupo de átomos é substituído por um radical do outro reagente, ou seja, ocorre na molécula a troca de um ligante.

Repare que um hidrogênio da molécula de Metano foi substituído por um átomo de cloro, dando origem aos produtos cloro-metano e cloreto de hidrogênio.
Reação de Eliminação
Nesse tipo de reação ocorre a saída de ligantes de uma molécula sem que aconteça a substituição desses ligantes por outros.

A desidratação intramolecular de alcoóis é uma reação de Eliminação, onde os átomos na molécula do reagente orgânico (propanol) diminuem em razão da saída da molécula de água
ESTUDEM BASTANTE E CONTEM CONOSCO!
Segunda Avaliação
27/10/2016
Funções Orgânicas
Hidrocarbonetos
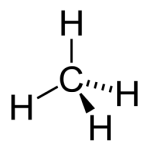
São compostos constituídos por, apenas, átomos de carbono e hidrogênio. Sendo essa função composta por uma ampla gama de combustíveis (metano, propano, acetileno).Alcoóis
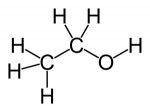
Os alcoóis são constituídos por radicais de hidrocarbonetos ligados a uma ou mais hidroxilas. Entretanto, nunca podem ser considerados bases de Arrhenius (pois não liberam essa hidroxila em meio aquoso).Fenóis
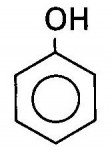
São cadeias aromáticas (hidrocarbonetos) ligados a uma ou mais hidroxilas Diferindo-se dos alcoóis, portanto, por apresentarem estrutura em anéis rodeados por grupos OH.Éteres
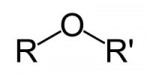
São compostos por um átomo de oxigênio entre duas cadeias carbônicas. Sendo estas cadeias também de hidrocarbonetos (radicais alquila ou arila).Ésteres
São semelhantes aos éteres por possuírem átomos de oxigênio entre as cadeias carbônicas (radicais). Porém, diferem-se destes por possuírem um grupo carbonilo (CO) também entre os carbonos. Assim, a molécula é estruturada por: radical – carbonilo – oxigênio – radical.Aldeídos
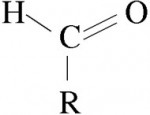
São formados por um radical orgânico (alifático ou aromático) ligado a um ou mais grupos formilo (HCO).Cetonas
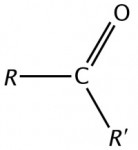
São compostas por dois radicais orgânicos (alifáticos ou aromáticos) ligados entre si pelo grupo carbonilo (CO). É a essa função que pertence a acetona comercial (propanona - CH3COCH3).Ácidos carboxílicos
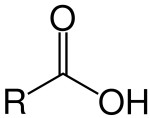
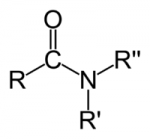
São radicais alquila, alquenila, arila ou hidrogênio ligados a pelo menos um grupo carboxílico (COOH). E, geralmente, são ácidos fracos (liberam poucos íons H+ em meio aquoso).Aminas
São compostos nitrogenados onde até três radicais orgânicos (arila ou alquila) se ligam a um átomo de nitrogênio pela substituição de átomos de hidrogênio da molécula de amônia. De modo que um radical liga-se ao -NH2, dois radicais a -NH e três radicais a -N.Amidas
São bem parecidas com as aminas, exceto pela presença do grupo carbonilo. Assim, até três radicais acila (RCO) se ligam a um átomo de nitrogênio pela substituição de átomos de hidrogênio do amoníaco. Ou seja, as amidas possíveis são: RCONH2, (RCO)2NH, e (RCO)3N.Haletos orgânicos
São compostos formados por halogênios (com NOx -1) que substituem átomos de hidrogênio pela reação de halogenação. É nessa função orgânica que se encontram os CFC (clorofluorcarbonetos).
Propriedades físicas e químicas dos compostos orgânicos
Polaridade:
Sempre que o carbono estiver ligado a um átomo de hidrogênio ou a outro carbono, a ligação será apolar, pois não há diferença de eletronegatividade, isto é, o par de elétrons compartilhado fica equidistante dos dois átomos e não é atraído com maior intensidade por nenhum deles.
.jpg)
Por exemplo, o gás butano é um composto orgânico e só possui ligações covalentes entre carbonos e hidrogênios. Visto que só possui ligações apolares, essa é uma molécula apolar:
.jpg)
Por outro lado, no caso de ligações do carbono (ou do hidrogênio) com outros elementos químicos mais eletronegativos, tais como o oxigênio, o enxofre ou os halogênios, então a ligação será polar e a molécula também será considerada polar.
Exemplo: O etanol possui uma região polar (OH) e uma região apolar (H3C — CH2 —), mas a sua molécula é classificada como polar:
.jpg)
- Solubilidade:
Os compostos orgânicos seguem a regra do “semelhante dissolve semelhante”, ou seja, os compostos polares dissolvem-se em outros compostos orgânicos polares, enquanto os apolares dissolvem-se nos apolares.
Por exemplo, a graxa é apolar e dissolve-se na gasolina, que também é apolar. É por isso que não conseguimos limpar a mão suja de graxa com água, que é um solvente polar. Além disso, é em virtude desse fato que a gasolina também não se mistura com a água.
.jpg)
Mãos sujas de graxa e gasolina em estrada não se misturando com a água
- Forças intermoleculares:
As forças intermoleculares existentes nos compostos orgânicos são fracas em comparação às forças dos compostos inorgânicos.
A força intermolecular mais intensa é a ligação de hidrogênio, seguida da força de dipolo permanente, e a mais fraca é a de dipolo induzido. Assim, quando comparamos os compostos orgânicos entre si, os que possuem o grupo OH, tais como os álcoois e os ácidos carboxílicos, realizam ligações de hidrogênio e, por isso, possuem as interações mais fortes entre suas moléculas.
- Estados físicos:
Em virtude dessa baixa intensidade das interações intermoleculares, existem compostos orgânicos nos três estados físicos em temperatura ambiente. Abaixo temos exemplos de três compostos orgânicos que estão em estados físicos distintos:
.jpg)
Compostos orgânicos nos três estados físicos
- Pontos de fusão e ebulição:
Se comparados às substâncias inorgânicas iônicas ou metálicas, os pontos de fusão e ebulição dos compostos orgânicos são menores. Isso acontece principalmente porque, conforme dito, as suas forças intermoleculares são menos intensas, assim é necessário fornecer menos energia para rompê-las e mudar de estado físico.
Ao compararmos os próprios compostos orgânicos, aqueles que realizam as ligações de hidrogênio, tendo o grupo hidroxila (OH) em sua molécula, possuem maiores pontos de fusão e ebulição. Por exemplo, o metanol possui ponto de ebulição igual a + 64,8ºC em condições normais de temperatura e pressão, já o ponto de ebulição do metano é de -161,5, um valor bem inferior. Isso acontece porque o metanol possui o grupo OH.
Por outro lado, compostos orgânicos pertencentes a um mesmo grupo funcional dependem da massa molecular. Quanto maior a massa molecular, maior será a cadeia carbônica. Por exemplo, o ponto de ebulição do ácido metanoico ao nível do mar é de 100,6 ºC, enquanto o do ácido etanoico é de 118,2ºC. Apesar de ambos serem ácidos carboxílicos, o ácido etanoico tem ponto de ebulição maior porque ele possui um carbono e dois hidrogênios a mais, tendo massa molecular maior.
- Combustibilidade:
A maior parte das substâncias orgânicas é combustível, ou seja, entra em combustão, reagindo com o oxigênio quando há uma ignição que inicia a reação que libera energia na forma de calor. Eles podem ser sólidos como a madeira, líquidos como a gasolina e o álcool ou gasosos como o butano.
Isso mostra que os compostos orgânicos são responsáveis por grande parte da energia que consumimos, desde o que mantém nossos fogões acesos (gás butano) até os combustíveis de nossos automóveis.
.jpg)
Os combustíveis usados nos automóveis são todos compostos orgânicos
Entretanto, existem algumas exceções, tais como o clorofórmio e o acetato de sódio, que não são compostos combustíveis.

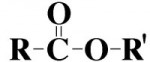
Deixem seus comentários e dúvidas! :D
ResponderExcluir